肠道-脑轴新突破!Nat Methods:诱导多能干细胞变身「内脏感觉神经节类器官」,揭示神经疾病奥秘
来源:生物谷原创 2024-11-15 13:51
该研究成功创建了从诱导多能干细胞分化出VSGO的方法,并构建了轴-芯片模型以探究VSGO在神经疾病中的作用,发现VSN可能是肠道-脑轴中病理蛋白传播的潜在介质,为神经疾病研究带来了新的模型和思路。
 在神经科学领域,肠道-脑轴(gut-brain axis,肠道与大脑之间的相互作用)的研究越来越受到重视。肠道微生物组在多种神经疾病患者中发生了变化,而调控这些微生物可以减轻小鼠模型中的神经疾病症状。尽管免疫系统和肠道-血液-脑轴(gut-blood-brain axis)的作用受到了广泛关注,但迷走神经(vagus nerve)——这条连接大脑和肠道的重要通道——的作用也不容忽视。
在神经科学领域,肠道-脑轴(gut-brain axis,肠道与大脑之间的相互作用)的研究越来越受到重视。肠道微生物组在多种神经疾病患者中发生了变化,而调控这些微生物可以减轻小鼠模型中的神经疾病症状。尽管免疫系统和肠道-血液-脑轴(gut-blood-brain axis)的作用受到了广泛关注,但迷走神经(vagus nerve)——这条连接大脑和肠道的重要通道——的作用也不容忽视。
与此同时,随着干细胞技术的进步,科学家们已经能够从诱导多能干细胞(induced pluripotent stem cells, iPSCs)中产生各种细胞和类器官(organoids,实验室中培养的微型器官)。然而,生成内脏感觉神经元(visceral sensory neurons, VSNs)的方案尚未完善。这些神经元对于理解肠道-脑轴在神经疾病中的作用可能具有重要意义。
近日,韩国首尔大学的Inhee Mook-Jung研究团队在《自然·方法》(Nature Methods)上发表了一篇题为“Differentiating Visceral Sensory Ganglion Organoids from Induced Pluripotent Stem Cells”的研究论文。该研究成功创建了一种从iPSCs分化出内脏感觉神经节类器官(visceral sensory ganglion organoids, VSGOs)的方法。
分化过程及验证
研究人员通过一系列特定的方法和调控,成功地将iPSCs分化为内脏感觉神经节类器官。在这个过程中,他们使用了定量PCR和免疫染色技术进行验证。例如,PAX2基因在分化过程中表达量较高,而TFAP2A和PAX8基因的表达量有所降低,这为分化过程的准确性提供了有力的证据。
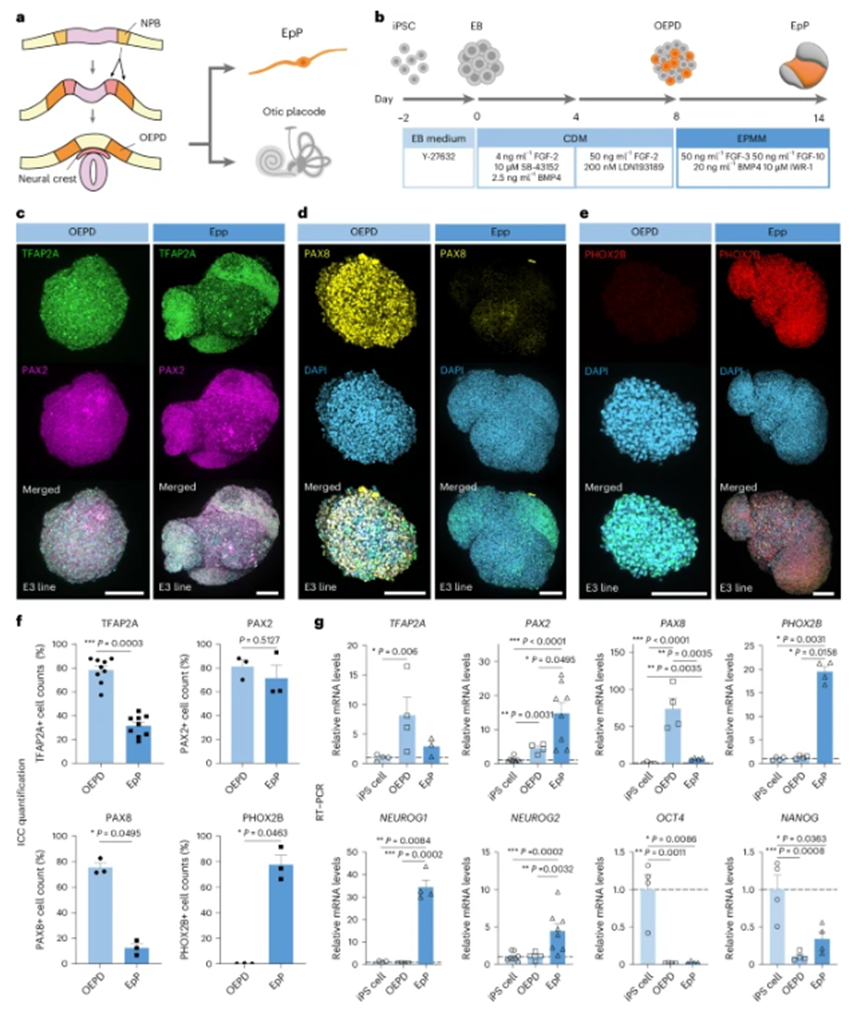
图1:从iPS细胞中分化OEPD和EpP
VSGO和i-VSN的分化及验证
以早期阶段的细胞为基础,通过添加多种生长因子,研究团队成功分化出了VSGO和内脏感觉神经元(i-VSNs)。免疫染色结果显示,VSGO能够表达多种典型的神经节标记物,如PHOX2B和PIEZO1。此外,钙成像和膜片钳分析表明,VSGO具备功能性,并且包含多种对不同化学物质有反应的i-VSN群体。
单细胞RNA分析结果
通过对i-VSNs和VSGO进行单细胞RNA测序并整合分析,研究团队确定了多种细胞类型,包括VSNs、施万样细胞(Schwann-like cells, SCs)、卫星胶质样细胞(satellite glia-like cells, SGCs)以及EpP样细胞(EpP-like cells, EpPLs)。这些细胞类型各自具有独特的标记基因表达模式,为深入了解细胞的组成和特性提供了基础。

图2:VSGO单细胞RNA分析
发育轨迹分析
通过轨迹分析技术,研究团队揭示了VSGO分化的发育途径。他们发现了多种祖细胞类型,如边境未决定祖细胞(borderline undetermined progenitors, BLUPs),以及不同的分化轨迹,如BLUPs-NEpP2和BLUPs-OEPD-NEpP1等。这些发现确定了相关的关键驱动基因,对于理解细胞分化的机制和调控具有重要意义。
亚簇分析
亚簇分析显示,VSNs具有明显的异质性。不同亚簇能够表达不同的神经肽受体和神经递质。例如,某些亚簇表达P2RX家族受体,并且在神经递质分泌方面,不同亚簇对血清素、去甲肾上腺素等的分泌情况各不相同。这体现了VSNs在功能和分子表达上的多样性。
轴-芯片模型结果
研究团队成功设计并构建了微流控芯片,将VSGO与人结肠类器官(human colon organoids, HCOs)连接起来,形成了3D轴-芯片模型。通过填充细胞外基质,有效减少了分子扩散。免疫染色观察到芯片上的神经连接,并利用逆行跨突触伪狂犬病毒验证了VSGO和HCOs之间的直接连接。
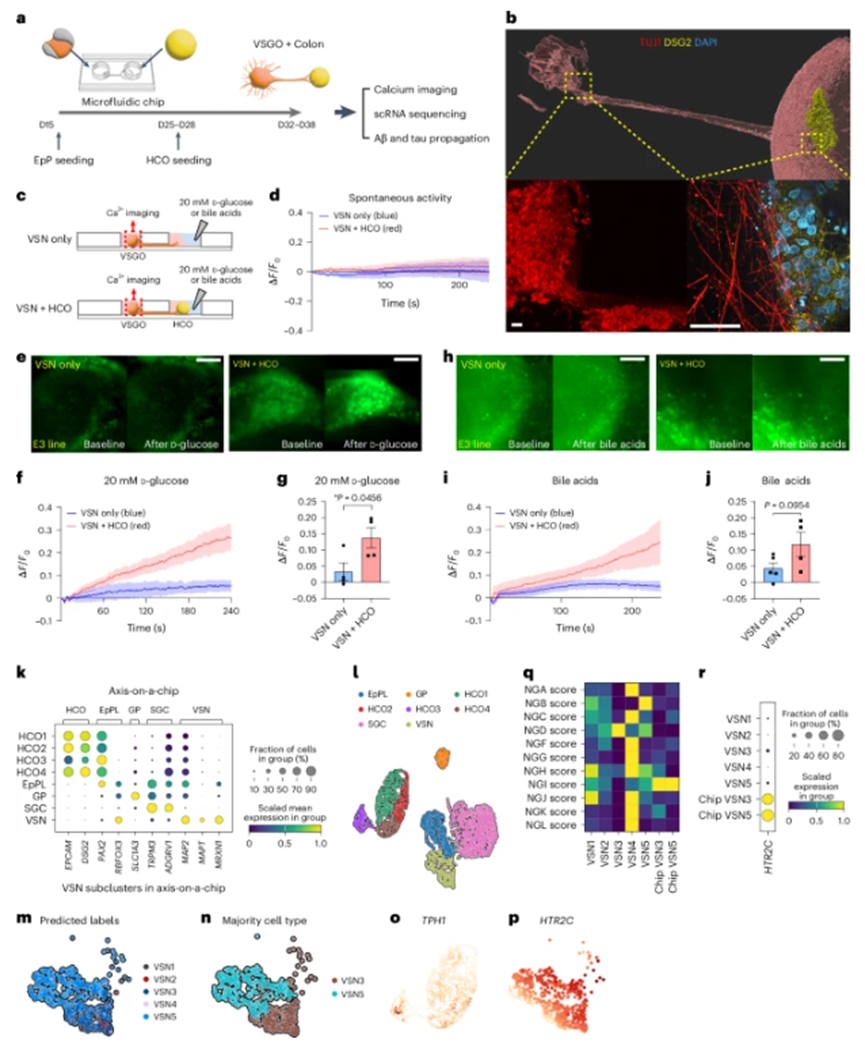
图3:使用微流控芯片建立连接VSGO和HCO的3D轴-芯片
功能连接验证
钙成像结果显示,VSN在与HCO连接时对葡萄糖和胆汁酸会产生特定的反应,从而验证了两者之间存在功能连接。对轴-芯片上的类器官进行单细胞分析,确定了HCO和VSN的不同细胞簇以及相关标记基因表达情况,并且发现这种连接会导致转录组发生改变,进一步说明了两者之间的紧密联系和相互影响。
在AD研究中的应用结果
在轴-芯片模型中研究Aβ(淀粉样蛋白β)和tau(tau蛋白)传播时,研究团队发现VSNs可能是这些病理蛋白传播的潜在介质。APOE4(载脂蛋白E4)和LRP1(低密度脂蛋白受体相关蛋白1)对传播过程产生了影响。通过比较不同iPSCs来源的VSNs,发现APOE4会影响亚簇的分布及基因表达。对内脏运动神经元(visceral motor neurons, VMNs)的研究表明,其在Aβ和tau传播过程中的作用小于VSNs。应用患者来源的iPSCs构建轴-芯片模型,发现Aβ和tau的传播与临床数据之间存在相关性,为研究AD的发病机制和相关治疗提供了新的视角和依据。
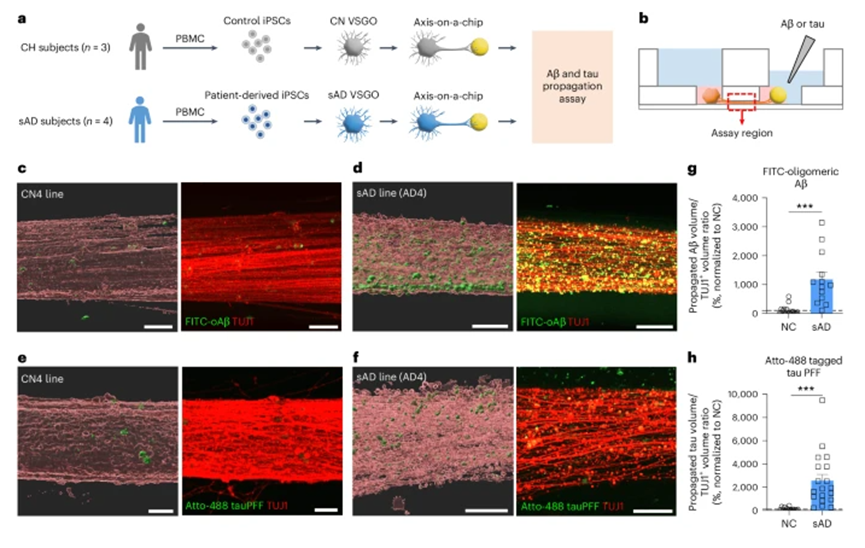
图4:患者来源的内脏感觉神经节类器官(VSGO)的Aβ和tau传播测定
这项研究成功建立了从iPSCs分化内脏感觉神经节类器官的方法,并通过多维度研究验证了其分化过程及特性。构建的轴-芯片模型在神经疾病研究中显示出VSNs可能是肠道-脑轴中病理蛋白传播的潜在介质,受APOE4和LRP1影响,且与临床数据相关。这项研究为神经疾病研究提供了新的模型和思路,有助于深入理解肠道-神经-脑轴在神经疾病中的作用机制,对未来相关疾病的治疗和研究具有重要意义。(生物谷Bioon.com)
参考文献:
Ahn, K., Park, HS., Choi, S. et al. Differentiating visceral sensory ganglion organoids from induced pluripotent stem cells. Nat Methods (2024). https://doi.org/10.1038/s41592-024-02455-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


